DEGEA live – die neuen KRINKO-Empfehlungen zur Aufbereitung flexibler Endoskope
Dr. Weigert Webinar

Im Dezember 2024 berichteten Experten im Rahmen eines Dr. Weigert Webinars über die Neuerungen, die die Anlage 8 zur KRINKO-Empfehlung im Hinblick auf die Endoskopaufbereitung mit sich gebracht haben. Durch die gesamte Veranstaltung führte die DEGEA-Vorsitzende Ulrike Beilenhoff, unterstützt wurde sie dabei von Marcel Jung und Guido Merk von Dr. Weigert. Weitere Referenten waren Marc Thanheiser vom RKI, Berlin und Prof. Dr. rer. Nat. Heike Martiny, TechnischeHygiene, Berlin.
Der Name „Kommission für Infektionsprävention in medizinischen Einrichtungen und in Einrichtungen und Unternehmen der Pflege und Eingliederungshilfe“ wurde von der Kommission geändert, das Kürzel KRINKO bleibt jedoch bestehen. Die Überarbeitung der Anlagen zur KRIN KO-/BfArM-Empfehlung aus dem Jahr 2012 zielte darauf ab, die Empfehlung prägnant zu halten und gleichzeitig zusätzliche Themen wie die Anforderungen an die Aufbereitung flexibler Endoskope zu integrieren. Die neue Anlage 8 ersetzt die KRINKO-Endoskop-Empfehlung von 2002, die inhaltlich nahezu identisch und bereits über 20 Jahre alt war.
Marc Thanheiser vom RKI erläuterte den rechtlichen Rahmen und Hintergrund der Anlage 8 und betonte die Bedeutung der KRINKO-/BfArM-Empfehlung: Bei Befolgung der Empfehlung wird eine ordnungsgemäße Aufbereitung vermutet (Vermutungswirkung). Abweichungen sind möglich, jedoch liegt die Beweispflicht bei den Verantwortlichen, d. h. sie müssen nachweisen, dass der Aufbereitungsprozess ordnungsgemäß durchgeführt wurde und die gewünschten Ergebnisse liefert. Diese Vermutungswirkung gilt für alle KRINKO-Empfehlungen. Thanheiser betonte die modulare Struktur der Empfehlungen, die durch Tabellen und informative Anhänge ergänzt wird, um eine umfassende Informationsbasis zu bieten. Die informativen Anhänge haben keinen gesetzgebenden Charakter, son dern dienen der weiterführenden Informa tion. Er hob die Bedeutung sensitiver Me thoden hervor und verwies auf die Veröf fentlichung zur Elution von Instrumentier kanälen mittels Flush-Brush-Flush-Verfah ren. Abschließend stellte er klar, dass die infektionshygienische Überwachung von Gesundheitseinrichtungen Ländersache ist; es wird also empfohlen, sich mit den zuständigen Behörden vor Ort zu beraten und Maßnahmen abzustimmen.
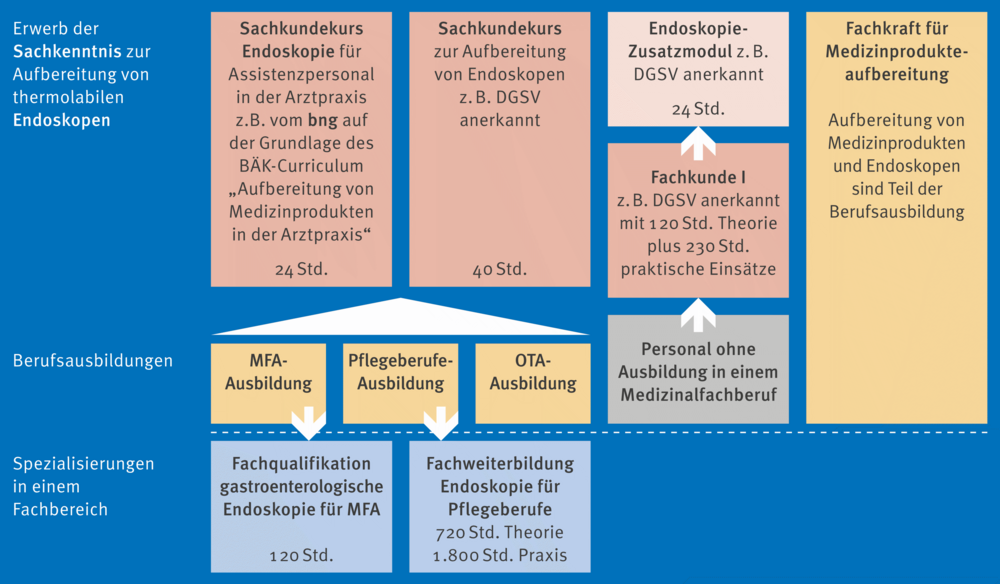
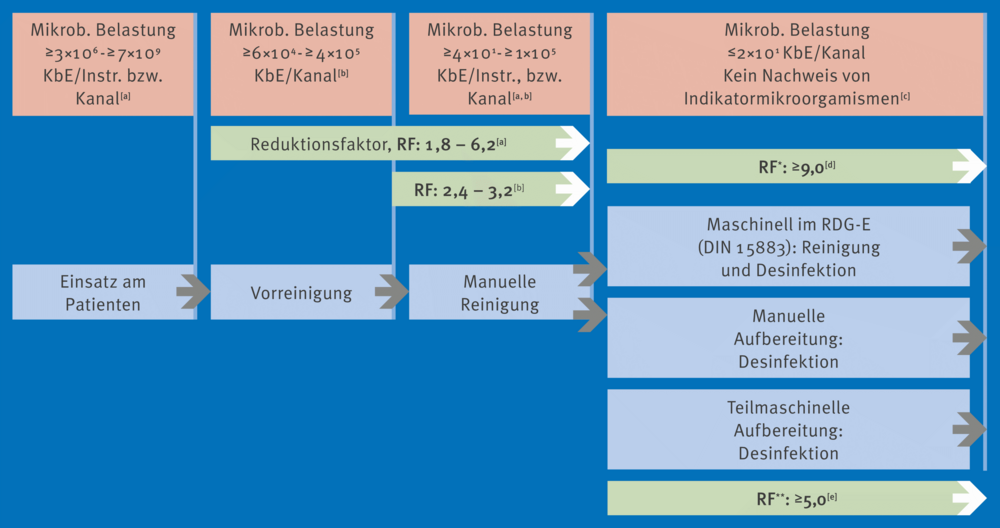
Ulrike Beilenhoff stellte eine ganze Reihe von Änderungen vor. Unter anderem zeigte sie Studienergebnisse, die darauf hin deuten, dass unter Zeitdruck wichtige Schritte in der Endoskopaufbereitung, z. B. das Bürsten oder Trocknen, vernachlässigt werden. Sie präsentierte Ergebnisse mikrobiologischer Untersuchungen an aufbereiteten Endoskopen, die eine Zunahme der mikrobiellen Belastung bei Bronchoskopen und Endoskopen für die Endosonografie (EUS-Endoskope) über die Zeit zeigten. Auch die Qualifikation der Mitarbeitenden ist von entscheidender Bedeutung. Die Anlage 8 enthält folgendes Fließschema dazu (siehe Abb. 1). Für die Personalqualifikation ist es besonders wichtig, auf Endoskopie-spezifische Kurse zu achten, die zusätzlich die Sachkunde umfassen. Hier zeigte sich bereits eine deutliche Verbesserung der Personalqualifikation im Vergleich zwischen 2015 und 2022. Die Aufbereitungsräume für die Endoskopie werden weiterhin in die Kategorie B eingeordnet, wie im Hauptdokument der KRINKO/BfArM-Empfehlung angegeben. Vorgaben zur Raumgröße fehlen jedoch, was Beilenhoff erläuterte. Die Größe muss demnach stets den Anforderungen der je weiligen Bereiche angepasst werden. Zu dem sind Ausfallkonzepte bei der Planung zu berücksichtigen. Hilfestellungen dazu sind in der neuen Anlage 8 enthalten. Bei der Aufbereitung in der AEMP sind Transportzeiten zu beachten. Wenn der Transport länger als 30 Minuten dauert, sollte dies als „Worst Case“ validiert wer den, so Beilenhoff. Anhand der Abb. 2 aus der Anlage 8 erklärte sie die Reduktion an Log-Stufen, die die einzelnen Schritte er bringen. Die manuellen Schritte erreichen bis über 6 Log-Stufen, was ihre Bedeutung unterstreicht. Es gibt verschiedene Möglichkeiten der Lagerung und Trocknung, wobei Trocken schränke nicht verpflichtend sind. Die Trocknung mit Druckluft bleibt weiterhin eine Option, ebenso die liegende Lage rung oder die Lagerung in einer Box. Es ist jedoch entscheidend, dies entsprechend zu validieren.
Heike Martiny verwies in ihrem Vortrag ins besondere auf Teil 3 der Anlage 8: Manuelle oder teilmaschinelle Verfahren müssen zu den gleichen Ergebnissen führen wie maschinelle Aufbereitungsprozesse. Zudem erläuterte sie die Begriffe „Prozessleistung“, die durch den Einsatz von Prüfkörpern ermittelt werden, um festzustellen, ob die geforderten Parameter erreicht wurden, sowie „Prozesswirkung“, die ausschließlich am realen Instrument nach der Aufbereitung überprüft werden kann. Die Prozesskontrolle der Reinigungsleistung erfolgt durch Schlauchprüfkörper mit definierter Prüfanschmutzung (koaguliertes Schafblut). Die Gesamtprozessleistung wird auf ähnliche Weise überprüft, jedoch mit einer Prüfanschmutzung aus koaguliertem Schafblut und Prüforganismen. Neu ist, dass die Elution der Mikroorganismen nun aus allen vorhandenen Kanälen erfolgen soll, nicht mehr nur aus dem Biopsiekanal.
Heike Martiny stellte neue Begriffe vor, da runter die sog. „Eingriffsgrenze“ (> 200 μg Restprotein pro beprobtes Teilstück/Endo skopkanal). Dieser Wert, der aus der Überwachung abgeleitet wird, erfordert ein sofortiges Eingreifen. Des Weiteren wurde die „Warngrenze“ (> 100 μg Restprotein) eingeführt, die als Frühwarnsystem für Abweichungen von spezifischen Bedingungen dient. Sie betonte die Notwendigkeit, nicht bis zur Erreichung der Eingriffsgrenze zu warten; bereits bei Erreichen der Warn grenze ist ein Handeln erforderlich. Diese Vorgehensweise ist in Anlage 8 klar defi niert. Die Frage, ob das Endoskop in der Zwischenzeit weiterhin verwendet werden kann, muss durch eine Risikobewertung geklärt werden.
Bei der Gesamtprozesskontrolle muss ein mikrobieller Reduktionsfaktor von 9 Log Stufen erreicht werden. Zu den Akzeptanzkriterien für Prozesskontrollen merkte Heike Martiny an, dass diese für die Reinigungsleistung nach Etablierung neuer Prüfmethoden festgelegt werden. Die Prüfmethoden werden Anfang dieses Jahres veröffentlicht.
Die Akzeptanzkriterien für Produktkontrollen an den aufbereiteten Endoskopen beinhalten neue Grenzwerte. Die Warn grenze liegt nun bei 20 KBE pro Endoskop (im Gegensatz zu früher, als sie pro 20 ml galt) und die Eingriffsgrenze beträgt 100 KBE pro Endoskop. Diese Werte orientieren sich an amerikanischen und französischen Leitlinien und sind somit praktikabel.
Bei periodischen Überprüfungen müssen insbesondere große Abteilungen sinnvolle Intervalle festlegen, die für sie praktikabel sind. Eine vierteljährliche Überprüfung sei aus organisatorischen Gründen weiterhin sinnvoll, obgleich bei unauffälligen perio dischen Produktkontrollen das Prüfinter vall verlängert werden kann.
Abschließend äußerte Heike Martiny die Hoffnung, dass die neue Anlage 8 eindeutiger als die vorherige Version formuliert ist.